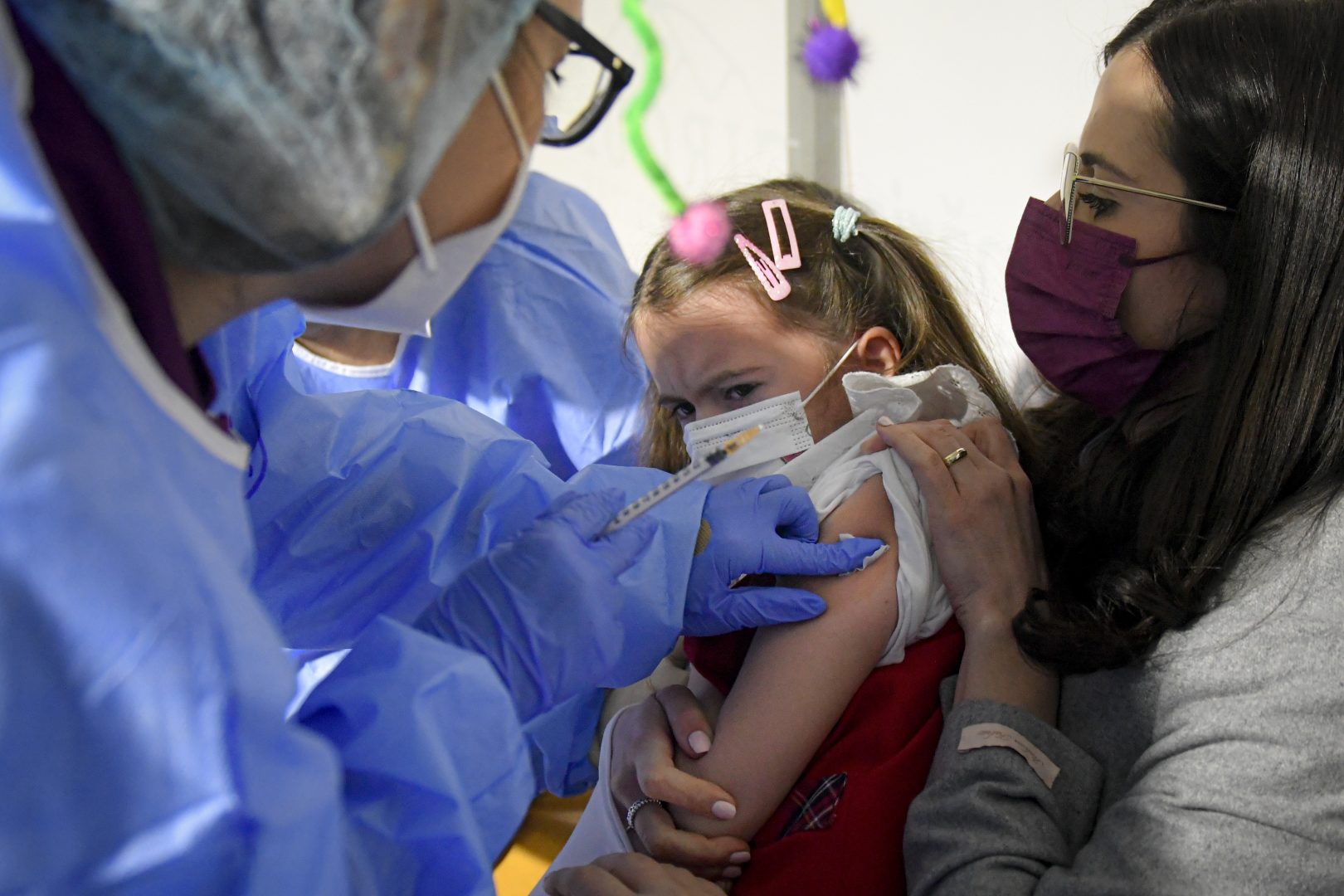
US Food and Drug Administration (FDA) обяви в петък, че отлага заседанието на своята Консултативна комисия по ваксините и свързаните с тях биопродукти. Тя беше предвидена за 15 февруари, но забавянето се е наложило поради "наскоро появили се нови данни", които имат отношение към искането за разрешение за спешна употреба на ваксината на Pfizer/Biontech за деца под 5 години.
От FDA поясниха, че отлагането ще даде време за разглеждане на новите данни и ще направи възможна прозрачната обществена дискусия "като част от обичайните ни научни и регулаторни процеси за COVID-ваксините".
Pfizer съобщи в петък, че продължава да предава данни на FDA относно резултатите на ваксината при деца. Бързият скок на случаите на Омикрон, повишеното ниво на заразяване и заболеваемост сред децата разрешиха фирмата да събере за кратко време нужните й данни за изследователските протоколи.
Pfizer/Biontech очакват през април данни за защитата, която се осигурява от тридозовата програма за ваксиниране. Удължаването на срока ще даде на FDA време да разгледа данните за двудозовия и тридозовия режим на прилагане на ваксината.
Помогни BG VOICE да излиза на хартия
Подкрепете независимата журналистика! Вашите дарения ни помагат да продължаваме да ви предоставяме актуални, проверени и значими новини.