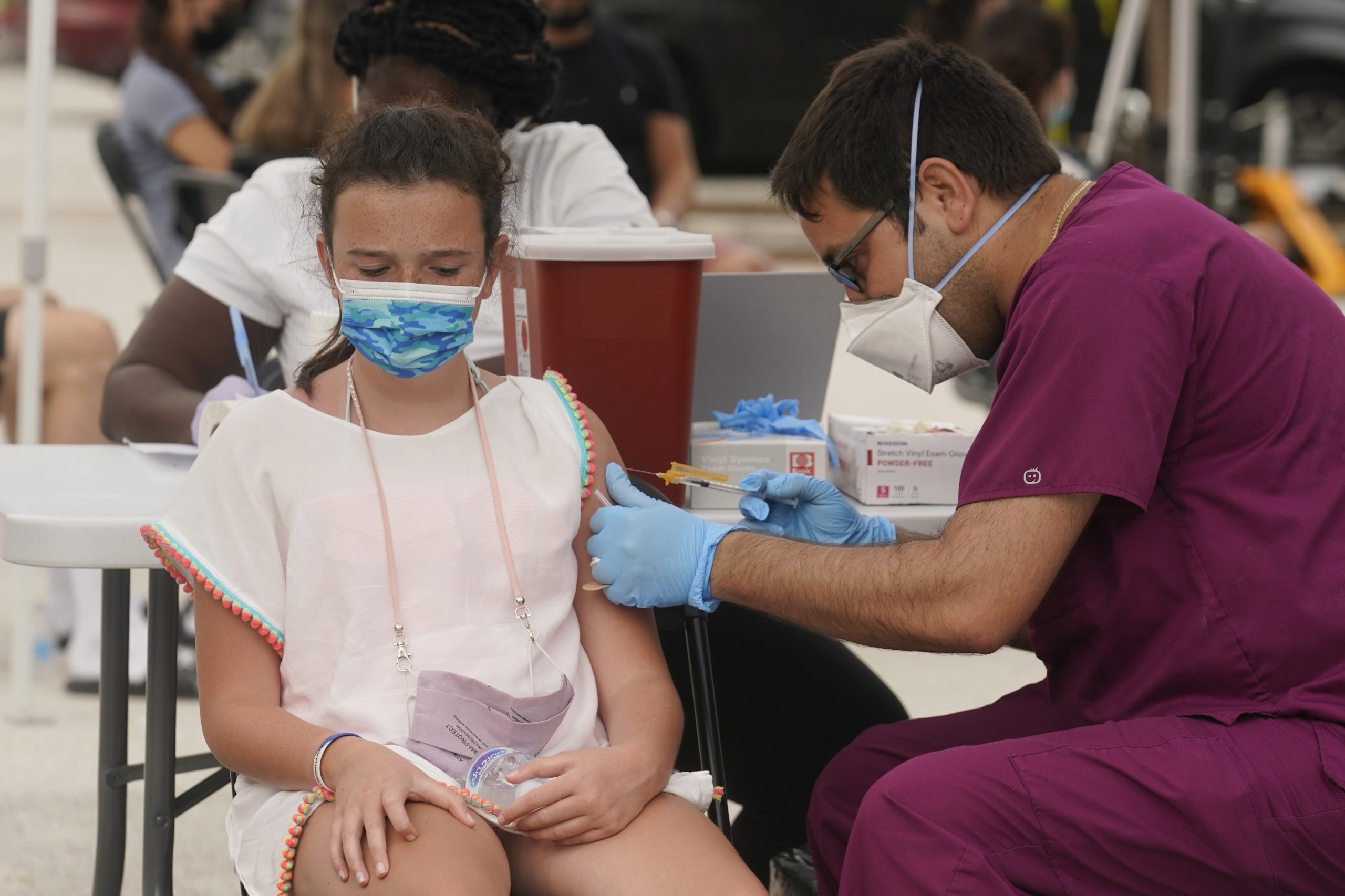
В дългоочаквано съобщение Pfizer заяви в понеделник, че втората фаза на клиничните изпитвания е показала, че ваксината срещу COVID-19 е безопасна и генерира "стабилен" отговор на антителата при деца на възраст от 5 до 11 години. Това са първите подобни резултати, публикувани за тази възрастова група. Pfizer заяви, че планира скоро да представи на Американската администрация по храните и лекарствата искане за разрешение за спешна употреба за тази възрастова група. Изпитването включваше 2268 участници на възраст от 5 до 11 години, при които беше използван двудозов режим на ваксината, прилаган с интервал от 21 дни. В това изпитване е използвана доза от 10 микрограма-по-малка от дозата от 30 микрограма, прилагана за децата над 12 години и възрастните. "Дозата от 10 микрограма беше внимателно подбрана като предпочитана доза за безопасност, поносимост и имуногенност при деца на възраст от 5 до 11 години", каза Pfizer. Имунният отговор на участниците се измерва чрез разглеждане на нивата на неутрализиращи антитела в кръвта им и сравняване на тези нива с контролна група от 16 до 25-годишни, на които е даден режим с две дози с по-голямата доза от 30 микрограма. Pfizer твърди, че нивата се сравняват добре с по-възрастните хора, които са получили по-голямата доза, демонстрирайки „силен имунен отговор в тази група деца един месец след втората доза“. „Освен това, ваксината срещу COVID-19 се понася добре, като страничните ефекти обикновено са сравними с тези, наблюдавани при участници на възраст от 16 до 25 години“, посочват от компанията. Говорител на Pfizer също потвърди, че няма случаи на миокардит, вид сърдечно възпаление, което се свързва с иРНК ваксините. От компанията потвърдиха, че тези данни ще бъдат включени в „краткосрочно представяне“ за EUA и компаниите ще продължат да натрупват данните, необходими за подаване на одобрение от FDA за хора на възраст от 5 до 11 години. Понастоящем ваксината Pfizer/BioNTech е одобрена за хора на възраст над 16 години и е разрешена за употреба при деца на възраст от 12 до 15 години. От компанията заявиха, че очаква пробни данни за деца на възраст над 6 месеца „веднага след четвъртото тримесечие на тази година“.